In questo video, parliamo di un interessante studio condotto a Taiwan, che indaga i possibili legami tra la risonanza di Schumann e l’insonnia.

I disturbi del sonno sono tra i problemi di salute più comuni del nostro tempo. Un recente studio condotto da esperti indaga la connessione tra la risonanza naturale di Schumann – le oscillazioni elettromagnetiche della Terra – e l'insonnia. I risultati forniscono spunti affascinanti sulla potenziale influenza delle frequenze naturali sul sonno umano.
Y U-Shu Huang (1,2), IT昂 (1), Wei-CH IH chin (1,2), l ing-S很GJ昂 (3), chin-pan glee (1,2), Chen Lin (4), C混-p爱yang (5,6), Shu-Lin GC ho (7)
(1) 1Dipartimento di psichiatria infantile e adolescenziale e Centro del sonno, Chang Gung Memorial Hospital, Taoyuan, Taiwan;
(2) Scuola di medicina dell’Università di Chang Gung, Taoyuan, Taiwan;
(3) Dipartimento di Ingegneria Elettrica, Università Nazionale di Cheng Kung, Tainan, Taiwan;
(4) Dipartimento di Scienze e Tecnologie Biomediche, Università Centrale Nazionale, Taoyuan, Taiwan;
(5) Dipartimento di Neurologia, Ospedale Generale Kuang Tien, Taichung, Taiwan;
(6) Dipartimento di Nutrizione, Università Huang Kuang, Taichung, Taiwan;
(7) Dipartimento di Psicologia Clinica, Università Cattolica Fu Jen, Nuova Taipei City, Taiwan;
Numerosi studi hanno dimostrato che i campi elettromagnetici possono influenzare il cervello umano e il sonno, e che i campi elettromagnetici a frequenza estremamente bassa, le cosiddette risonanze di Schumann, possono potenzialmente contribuire ad alleviare i disturbi del sonno. L’obiettivo di questo studio era quello di indagare le risposte dei pazienti con disturbi del sonno al trattamento non invasivo con risonanze di Schumann (SR) e di valutarne l’efficacia sulla base di valutazioni soggettive e oggettive del sonno.
Abbiamo utilizzato un disegno randomizzato in doppio cieco e 40 partecipanti (70% donne; età 50,00 ± 13,38 anni) con disturbi del sonno hanno completato l’intero studio. Questi partecipanti sono stati assegnati in modo casuale al gruppo del dispositivo per il sonno SR e al gruppo del dispositivo placebo e osservati per quattro settimane. Lo studio ha utilizzato la polisonnografia (PSG) per misurare il sonno oggettivo e i diari del sonno, il Pittsburgh Sleep Quality Inventory (PSQI), la Epworth Sleepiness Scale (ESS) e un’analogia visiva della soddisfazione del sonno per misurare il sonno soggettivo. Il Short-Form Health Survey (SF-36) a 36 item è stato utilizzato per valutare la qualità della vita. Il test del chi-quadrato, il test U di Mann-Whitney e il test dei ranghi con segno di Wilcoxon sono stati utilizzati per analizzare i dati.
Circa il 70% dei partecipanti erano donne con un’età media di 50 ± 13,38 anni e una storia media di disturbi del sonno di 9,68 ± 8,86 anni. Abbiamo riscontrato che nel gruppo trattato con il dispositivo per il sonno SR, le misurazioni oggettive del sonno (ora di inizio del sonno, SOL, e tempo totale di sonno, TST) e i questionari soggettivi del sonno (SOL, TST, efficienza del sonno, qualità del sonno, sonnolenza diurna e soddisfazione del sonno) sono migliorati significativamente dopo l’uso del dispositivo per il sonno SR; nel gruppo trattato con il dispositivo placebo, sono stati osservati solo miglioramenti soggettivi del sonno come PSQI e soddisfazione del sonno.
Diese Studie zeigt, dass das SR-Schlafgerät die Symptome von Schlaflosigkeit sowohl durch objektive als auch subjektive Tests mit minimalen Nebenwirkungen reduzieren kann. Zukünftige Studien können den möglichen Mechanismus von SR und die Auswirkungen auf die Gesundheit untersuchen und mit einer längeren Nachbeobachtungszeit die Wirksamkeit und Nebenwirkungen überprüfen.vinar dapibus leo.
Insonnia, risonanza di Schumann, efficacia, polisonnografia, questionario
L’insonnia è il disturbo del sonno più comune al mondo, colpendo fino al 10% della popolazione generale e circa il 15% degli adulti (1). Secondo la Classificazione Internazionale dei Disturbi del Sonno, Terza Edizione (ICSD-3), l’insonnia è definita come
(1) Difficoltà ad addormentarsi, a rimanere addormentati o a svegliarsi prima del tempo desiderato;
(2) Disturbi del sonno che causano significativo disagio personale o compromissione della vita quotidiana; e
(3) Disturbi del sonno e sintomi diurni associati che si verificano almeno tre volte alla settimana per un periodo di almeno tre mesi.
L’insonnia non comprende solo i disturbi del sonno notturno, ma anche il deterioramento delle funzioni diurne, come stanchezza, disturbi dell’attenzione e della memoria, deterioramento delle prestazioni sociali, accademiche o professionali e sbalzi d’umore.
Inoltre, molti studi hanno dimostrato che le persone che soffrono di insonnia hanno un rischio maggiore di malattie cardiovascolari, dolore cronico e diabete di tipo II.
Inoltre, il tasso di comorbilità tra insonnia e altri disturbi mentali è del 41-53%.
Dopo la terapia cognitivo-comportamentale per l’insonnia (CBTi), i pazienti con disturbi mentali comorbidi non solo riscontrano un miglioramento dei sintomi dell’insonnia, ma anche un miglioramento dei sintomi delle comorbidità.
Sebbene le caratteristiche fisiopatologiche dell’insonnia siano in gran parte sconosciute, vi sono sempre più prove che l’insonnia sia una condizione persistente e un disturbo complesso. Uno studio di coorte su 3.073 adulti seguiti annualmente per cinque anni ha confermato che il 41,6% dei partecipanti soffriva di insonnia persistente. Questa scoperta suggerisce che un intervento precoce potrebbe prevenire lo sviluppo di insonnia cronica e ridurre la morbilità associata a sedativi e sonniferi.
Studi precedenti hanno dimostrato che fino al 13% degli adulti negli Stati Uniti ha riferito di aver fatto uso di benzodiazepine nell’ultimo anno. Anche l’uso ambulatoriale di benzodiazepine è aumentato significativamente. L’uso a lungo termine e il sovradosaggio di sonniferi possono causare effetti collaterali.
Sebbene le linee guida per il trattamento dell’insonnia includano raccomandazioni cliniche consolidate per la CBTi come trattamento di prima linea, questo approccio non è ancora ampiamente adottato in molti Paesi. Inoltre, il disagio del paziente e l’aderenza alla CBTi rimangono sfide chiave nella sua implementazione. Pertanto, è importante indagare l’efficacia di altri trattamenti non farmacologici più recenti per l’insonnia.
Negli ultimi anni sono stati esplorati diversi metodi di trattamento non invasivi per l’insonnia, tra cui la terapia mindfulness, l’agopressione, l’agopuntura, la stimolazione elettromagnetica cranica (CES) e la stimolazione magnetica transcranica ripetitiva (rTMS). Un’altra scoperta significativa degli ultimi 20 anni è che le fluttuazioni elettromagnetiche nell’ambiente, come l’attività geomagnetica, possono influenzare la nostra fisiologia, psicologia e comportamento. Precedenti ricerche fisiche hanno dimostrato che le prestazioni elettroencefalografiche presentavano determinate associazioni con il lobo parietale destro per l’attività theta e la regione frontale destra per l’attività gamma, e alcuni studi hanno dimostrato moderate correlazioni tra un aumento dell’attività geomagnetica e varie conseguenze comportamentali dell’attività cerebrale.
Wang et al. (2019) hanno utilizzato uno studio elettroencefalografico (EEG) e hanno riportato una risposta forte e specifica del cervello umano alle rotazioni ecologicamente rilevanti dei campi magnetici terrestri. In seguito a stimolazione geomagnetica, è stata ripetutamente osservata una diminuzione dell’ampiezza delle oscillazioni alfa dell’EEG (8-13 Hz).
Nel 1954, Winfried Otto Schumann riportò l’esistenza di un campo naturale a bassissima frequenza di circa 7,83 Hz, la cosiddetta frequenza di risonanza di Schumann (SR), nell’atmosfera terrestre, che propaga le onde elettromagnetiche (EMW) a livello globale. La sua intensità massima può essere rilevata a circa 8 Hz, insieme alle sue armoniche di intensità inferiore a 14, 20, 26, 33, 39 e 45 Hz, dovute alle perdite di propagazione ionosferica legate alla frequenza.
Le risonanze di Schumann, riscontrate sia nell’attività elettroencefalografica quantitativa globale degli esseri umani sia nell’attività della ionosfera terrestre, potrebbero indicare una relazione causale.
Inoltre, Ghione et al. hanno riscontrato significative correlazioni positive tra l’attività geomagnetica e la pressione sanguigna sistolica (diurna e nell’arco delle 24 ore) e diastolica (diurna, notturna e nell’arco delle 24 ore). Burch et al. hanno inoltre scoperto che un aumento dell’attività geomagnetica in concomitanza con elevati campi magnetici a 60 Hz è associato a una ridotta escrezione notturna di un metabolita della melatonina negli esseri umani, a indicare che i campi elettromagnetici influenzano il cervello umano e il sonno.
Alla luce di questi risultati, la risonanza di Schumann a campi elettromagnetici a frequenza estremamente bassa potrebbe potenzialmente migliorare il sonno umano. In questo studio, utilizziamo un dispositivo per il sonno con funzione di “risonanza di Schumann” che emette la bassa frequenza dell'”onda di frequenza di risonanza di Schumann (7,83 Hz)” per entrare in risonanza con le onde cerebrali dell’utente, facilitando così l’addormentamento, il raggiungimento del sonno profondo e il mantenimento del sonno. Poiché l’efficacia e gli effetti collaterali delle “onde di Schumann” nel trattamento dell’insonnia non sono ancora chiari, questo studio mirava a indagare gli effetti della risonanza di Schumann sui sintomi dell’insonnia attraverso valutazioni soggettive e oggettive del sonno.
In questo studio, i pazienti affetti da insonnia sono stati reclutati tramite ambulatori ospedalieri e 46 partecipanti hanno soddisfatto i criteri di inclusione e hanno partecipato dopo aver fornito il consenso informato. Di questi, quattro hanno abbandonato lo studio perché non sono stati in grado di presentarsi alla visita di follow-up, mentre due partecipanti hanno manifestato mal di testa e vertigini dopo la randomizzazione e hanno interrotto il follow-up. In totale, 40 partecipanti hanno completato lo studio. Lo studio è stato pubblicato da Chang 1114 Powered by TCPDF (www.tcpdf.org) https://doi.org/10.2147/NSS.S346941 Nature and Science of Sleep 2022:14 Powered by TCPDF (www.tcpdf.org) DovePress Dovepress Huang et al Gung Hospital IRB: n. 201701063A3 e n. 202101267B0 (ID studio clinico: NCT05053919, periodo di studio: dal 27.7.2021 al 19.1.2022) ed è conforme alla Dichiarazione di Helsinki.
I criteri di inclusione includono (1) partecipanti di età compresa tra 20 e 70 anni; (2) i partecipanti devono soddisfare i criteri diagnostici del DSM-5 per l’insonnia e avere ricevuto la diagnosi da più di tre mesi; (3) i partecipanti devono essere disposti a firmare un modulo di consenso informato; e (4) i partecipanti che assumono farmaci per dormire devono accettare di non apportare modifiche ai loro farmaci o al dosaggio durante lo studio.
I criteri di esclusione includono (1) partecipanti che utilizzano pacemaker o monitor cardiaci; (2) partecipanti con gravi malattie fisiche o che hanno subito un intervento chirurgico, come malattie cardiache, disturbi metabolici o cancro; (3) partecipanti con gravi disturbi mentali, come schizofrenia, disturbo depressivo maggiore, grave disturbo d’ansia, disturbo bipolare, demenza o abuso di sostanze; o gravi disturbi neurologici, come convulsioni, ictus o morbo di Parkinson; (4) partecipanti con altri gravi disturbi del sonno, come grave apnea notturna ostruttiva, grave irrequietezza periodica o narcolessia; (5) partecipanti che non sono in grado di presentarsi agli appuntamenti di controllo regolari; e (6) partecipanti che non sono in grado di mantenere una buona igiene del sonno e non sono in grado di astenersi dall’utilizzare dispositivi elettronici prima di coricarsi.
Questo studio è stato randomizzato, in doppio cieco, caso-controllo. Tutti i partecipanti che soddisfacevano i criteri di inclusione sono stati assegnati in modo casuale al “gruppo dispositivo per il sonno SR” o al “gruppo dispositivo placebo”. Non sono state riscontrate differenze significative tra i due gruppi per quanto riguarda variabili di base come sesso, età e durata dell’insonnia.
Tutti i partecipanti sono stati assegnati in modo casuale a due gruppi e hanno utilizzato il “dispositivo per dormire” per quattro settimane.
L’endpoint primario è rappresentato dalle modifiche nella polisonnografia, mentre gli endpoint secondari sono le modifiche nei questionari soggettivi, tra cui il Pittsburgh Sleep Quality Inventory (PSQI) e l’Epworth Sleepiness Scale (ESS), i diari del sonno, la scala analogica visiva per la soddisfazione del sonno e il 36-Item Short-Form Health Survey (SF-36).
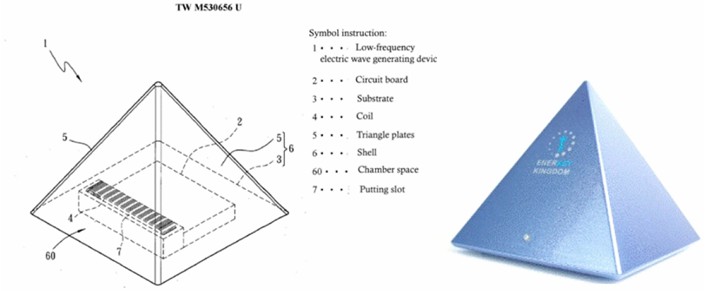
Il dispositivo SR è stato sviluppato dal Professor Ling-Sheng Zhang della National Cheng Kung University di Taiwan (Figura 1: “Dispositivo per il sonno Enerkey Kingdom SR”). Il dispositivo per il sonno era in grado di generare “l’onda di risonanza di Schumann a bassa frequenza (7,83 Hz)” e ha ottenuto il brevetto taiwanese n. TW M530656U il 4 maggio 2016. Una volta acceso, il dispositivo per il sonno emette stabilmente una frequenza composita composta da “onda di risonanza di Schumann (7,83 Hz), onda theta e onda delta”. Un dispositivo placebo è un dispositivo che ha aspetto e funzionamento identici al dispositivo per il sonno SR, ma non emette alcuna onda di frequenza. Ai soggetti è stato chiesto di utilizzare il dispositivo ogni notte per quattro settimane (posizionandolo accanto al letto in direzione della testa del soggetto, accendendolo circa un’ora prima di andare a dormire ogni notte e spegnendolo il giorno successivo al risveglio) e di registrare il loro sonno in appositi registri.
È stato eseguito uno studio polisonnografico notturno standard (PSG) per documentare il sonno di tutti i partecipanti prima dell’uso del dispositivo per il sonno SR/placebo e quattro settimane dopo l’uso. Ai partecipanti è stato chiesto di arrivare alle 21:00, di essere accompagnati da un tecnico del sonno nella sala visita dove è stato applicato loro un dispositivo con sensore e di sdraiarsi sul letto alle 22:00. L’esame si è concluso la mattina seguente alle 6:00 circa. L’esame polisonnografico notturno standard ha incluso il monitoraggio sistematico delle seguenti variabili: 4 derivazioni EEG, 2 derivazioni elettrooculografiche (EOG), derivazioni elettromiografiche (EMG) per mento e gambe e 1 derivazione elettrocardiografica (ECG). La respirazione è stata monitorata utilizzando un trasduttore di pressione per cannula nasale, un termistore oromucosale, fasce per pletismografia induttiva per torace e addome, un monitor digitale per la saturazione dell’ossigeno (Masimo™) che registrava i segnali di ossimetria e pletismografia digitale, un microfono laringeo, elettromiografia (EMG) dei muscoli diaframmatici-intercostali e addominali e un elettrodo transcutaneo per CO2; sono stati monitorati anche gli elettromiografia (EMG) degli arti inferiori. I soggetti sono stati sottoposti a videomonitoraggio continuo durante la registrazione. Le registrazioni sono state eseguite secondo le raccomandazioni dell’American Academy of Sleep Medicine (AASM) e anche la valutazione della PSG è stata eseguita secondo le raccomandazioni dell’AASM, con l’ipopnea valutata come una diminuzione del 3% della saturazione dell’ossigeno o come una risposta di risveglio.
I partecipanti hanno compilato un diario del sonno quotidianamente per due settimane prima di utilizzare il dispositivo SR/placebo e per quattro settimane durante l’utilizzo del dispositivo, per registrare il sonno. Dai diari sono state calcolate le stime medie di SOL, TST, SE e WASO.
Il PSQI è un questionario di autovalutazione della qualità soggettiva del sonno, composto da 19 domande, che possono essere calcolate e combinate in 7 punteggi dei componenti derivati clinicamente (0–3), con punteggi più alti che indicano una qualità del sonno peggiore.33,34 I partecipanti hanno completato il PSQI prima dell’uso, due settimane dopo l’uso e quattro settimane dopo l’uso del dispositivo per il sonno SR/dispositivo placebo.
L’ESS è composto da 8 elementi (ciascuno con un punteggio da 0 a 3) ed è stato utilizzato per valutare la sonnolenza diurna nei singoli individui. 35 partecipanti hanno completato l’ESS prima, due settimane dopo e quattro settimane dopo l’utilizzo del dispositivo per il sonno SR/dispositivo placebo.
Ai soggetti è stato anche chiesto di valutare il loro livello di soddisfazione in merito al sonno durante la settimana precedente, utilizzando una scala a sette punti, prima e quattro settimane dopo l’applicazione (un punteggio più alto indica una maggiore soddisfazione in merito al sonno).
L’SF-36 comprende 11 domande chiave che valutano otto componenti. Queste componenti includono il funzionamento fisico, le limitazioni dovute alla salute fisica, le limitazioni dovute a problemi emotivi, l’energia/affaticamento, il benessere emotivo, il funzionamento sociale, il dolore e lo stato di salute generale. La scala può essere utilizzata per valutare la qualità di vita complessiva di un paziente. Punteggi più alti indicano un migliore funzionamento fisico o mentale.
Abbiamo analizzato i nostri dati utilizzando SPSS 22.0. I dati sono stati presentati come conteggio, media, percentuale e deviazione standard. Abbiamo utilizzato il test del chi-quadrato per i confronti di gruppo della percentuale e il test U di Mann-Whitney per analizzare le differenze nelle misurazioni oggettive e soggettive tra il gruppo trattato con il dispositivo per il riflesso del sonno (SR) e il gruppo placebo. Abbiamo utilizzato il test dei ranghi con segno di Wilcoxon per analizzare le differenze prima e dopo l’utilizzo del dispositivo. Un valore p inferiore a 0,05 è stato considerato statisticamente significativo.
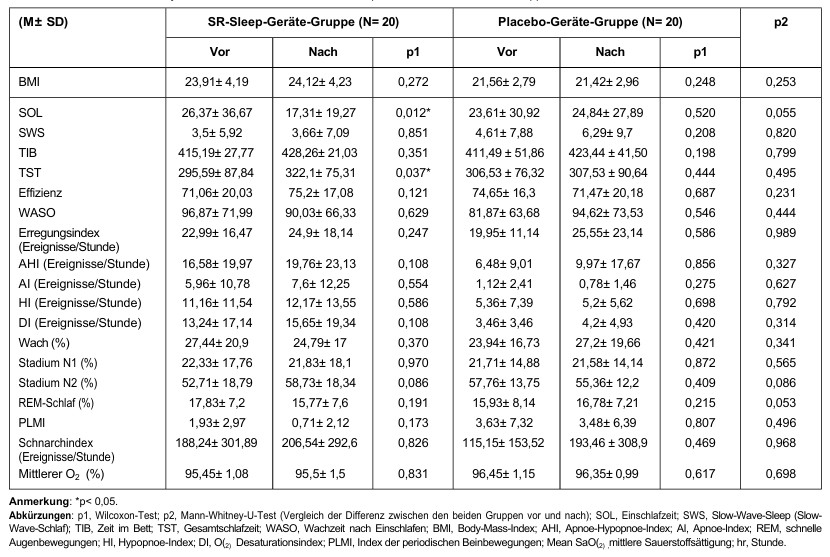
Circa il 70% dei 40 partecipanti erano donne con un’età media di 50 ± 13,38 anni e una storia media di disturbi del sonno di 9,68 ± 8,86 anni. La Tabella 1 elenca le caratteristiche dei partecipanti all’inizio dello studio. Non sono state riscontrate differenze significative tra i due gruppi per quanto riguarda sesso, età, durata dei disturbi del sonno, livello di istruzione, stato civile, stato socioeconomico o comorbilità.
I confronti delle misurazioni oggettive del sonno prima e quattro settimane dopo l’uso del dispositivo per il sonno SR/placebo sono mostrati nella Tabella 2. Nel gruppo del dispositivo per il sonno SR, è stata osservata una significativa diminuzione del SOL (p = 0,012) e un significativo aumento del TST (p = 0,037). Non è stata osservata alcuna differenza significativa nel gruppo del dispositivo placebo. Sebbene non vi fosse alcuna differenza significativa tra i due gruppi prima e dopo il trattamento (test U di Mann-Whitney), si è osservata una tendenza al miglioramento in molti parametri nel gruppo del dispositivo per il sonno SR, in particolare nel SOL (p = 0,055).
Tabella 1: Dati demografici del gruppo del dispositivo SR-Sleep e del gruppo del dispositivo placebo
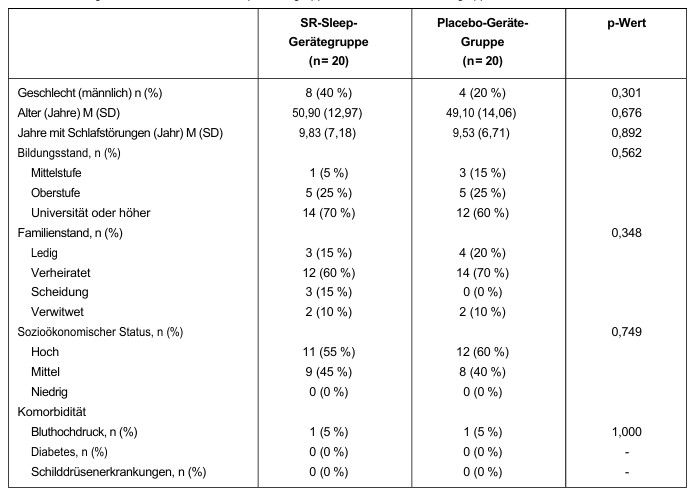
Tabella 2: Differenze nei risultati oggettivi del PSG nel gruppo dispositivo per il sonno SR/dispositivo placebo
Nella Tabella 3 sono riportati i confronti delle misurazioni soggettive del sonno prima, due settimane dopo e quattro settimane dopo l’uso del dispositivo per il sonno SR/dispositivo placebo.
Nel gruppo trattato con il dispositivo per il sonno SR, è stata osservata una diminuzione significativa del SOL (p = 0,004) e un aumento significativo del TST (p = 0,047) e dell’SE (p = 0,017) (tutte le differenze sono persistite tra il basale e la settimana 4). Non è stata osservata alcuna differenza significativa nel gruppo trattato con il dispositivo placebo.
Eine signifikante Verringerung des Schlaflatenzindex (p = 0,003, die Signifikanz lag zwischen „vorher, Woche 2” und „Woche 4”) wurde in der SR-Schlafgerät-Gruppe beobachtet, nicht jedoch in der Placebo-Gerät-Gruppe. Signifikante Verbesserungen des subjektiven Schlafqualitätsindex (pSR = 0,001 (vorher > Settimana 2, settimana 4); pplacebo = 0,042 (prima del trattamento) > Settimana 2)), dell´indicedi durate del sonno (pSR = 0,021 (prima del trattamento) > Settimana 2); pplacebo = 0,009 (prima del trattamento > Settimana 2, settimana 4)), dell ´indice totale (pSR = 0,034 (prima del trattamento > Settimana 2, settimana 4); pplacebo = 0,044 (prima > Settimana 2, settimana 4)) e ESS (pSR = 0,019 (prima > La settimana 4, p = 0,055)) é estata osservata in entrambi i gruppi. Inoltre, el parametro “qualità del sonno” è migliorato significativamente nel gruppo trattato con il dispositivo per il sonno SR (p = 0,046).
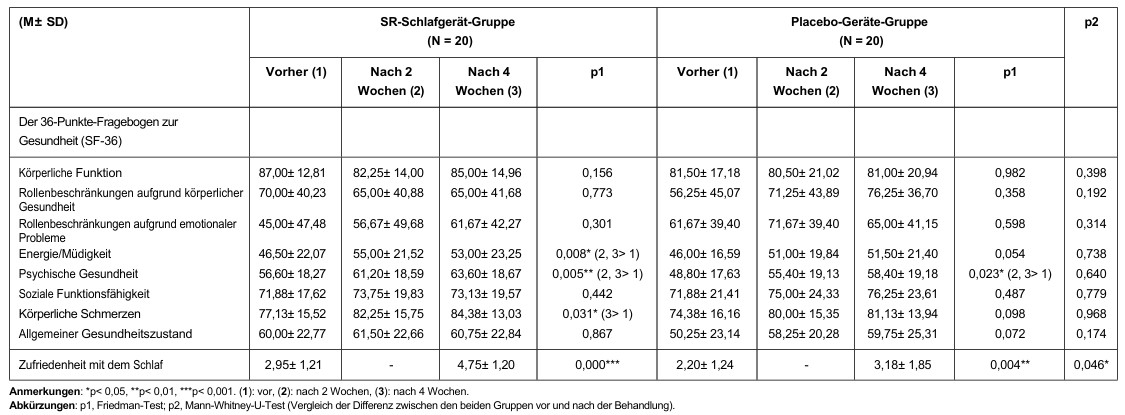
I confronti della qualità della vita soggettiva (SF-36) prima, 2 settimane dopo e 4 settimane dopo l’uso del dispositivo per il sonno SR/dispositivo placebo sono mostrati nella Tabella 4. Miglioramenti significativi nell’energia/affaticamento (p = 0,008) e nel dolore fisico (p = 0,031) sono stati osservati nel gruppo del dispositivo per il sonno SR, ma non nel gruppo del dispositivo placebo. Abbiamo osservato miglioramenti significativi nella salute mentale (pSR = 0,005; pPlacebo = 0,023) in entrambi i gruppi. La soddisfazione del sonno è migliorata significativamente in entrambi i gruppi (pSR <0,001; pPlacebo = 0,004). Inoltre, la variazione nel punteggio di soddisfazione del sonno rispetto al basale (p = 0,046) è stata maggiore nel gruppo del dispositivo per il sonno SR rispetto al gruppo del dispositivo placebo.
Tabella 3: Differenze nelle misurazioni soggettive del sonno nel gruppo dispositivo SR Sleep/dispositivo placebo
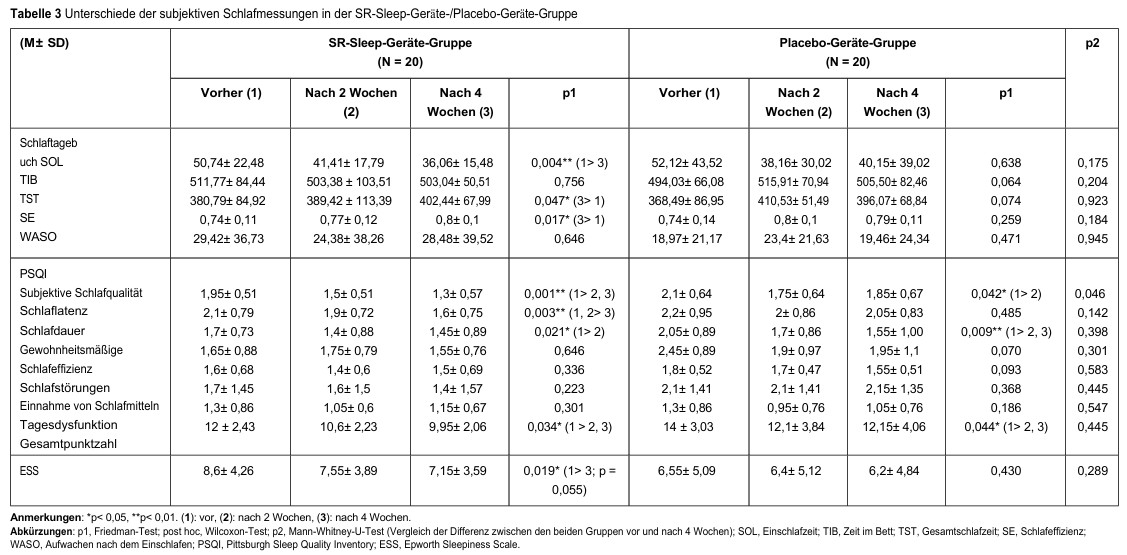
Tabella 4: Differenze tra l’indagine sulla salute (SF-36) e la soddisfazione del sonno nel gruppo dispositivo SR Sleep/dispositivo placebo
Dei 46 partecipanti, due hanno manifestato mal di testa e vertigini durante l’utilizzo del dispositivo (uno nel gruppo trattato con il dispositivo per il sonno SR e uno nel gruppo trattato con il dispositivo placebo) e hanno interrotto la terapia. Non si sono verificati altri eventi avversi.
Questo studio indaga se 40 partecipanti con disturbi del sonno possano ottenere miglioramenti nelle misurazioni soggettive e oggettive del sonno dopo quattro settimane di utilizzo di un dispositivo per il riflesso del sonno (SR) o di un dispositivo placebo. Solo due partecipanti hanno manifestato effetti collaterali come mal di testa e vertigini (gruppo di studio n = 1; gruppo placebo n = 1) e hanno interrotto lo studio. Questo studio è il primo a indagare se lo SR influenzi il sonno e i disturbi del sonno.
Nel gruppo trattato con il dispositivo per il sonno SR, sia le misurazioni oggettive del PSG (SOL e TST, ma non SWS) sia le misurazioni soggettive del sonno (SOL, TST, SE, qualità del sonno, sonnolenza diurna, soddisfazione del sonno) sono migliorate significativamente dopo l’utilizzo del dispositivo per il sonno SR. Tuttavia, nel gruppo trattato con il dispositivo placebo, le misurazioni oggettive del sonno non hanno mostrato differenze dopo l’utilizzo del dispositivo, e si è registrato solo un miglioramento soggettivo del sonno per quanto riguarda la soddisfazione del sonno e alcune componenti del PSQI.
Questo risultato suggerisce che la SR può ridurre i sintomi dell’insonnia, in particolare per quanto riguarda l’addormentamento e la durata totale del sonno. Un altro risultato importante è che il 55% del gruppo placebo ha mostrato un miglioramento secondo il PSQI e la scala di soddisfazione del sonno, il che può essere spiegato dal consueto effetto placebo nel trattamento dell’insonnia.
Non comprendiamo ancora appieno il meccanismo attraverso il quale la SR migliora l’insonnia e il sonno. Studi precedenti hanno dimostrato che i cambiamenti nell’attività geomagnetica sono associati a crisi epilettiche, infarto del miocardio, ictus e depressione. La magnetite biogenica offre un meccanismo molecolare per la percezione geomagnetica che è stato individuato nel cervello umano.
Cherry (2002) ha suggerito che la SR, che propaga onde a frequenza estremamente bassa (ELF) a livello globale, sia “il possibile meccanismo biologico” che spiega gli effetti biologici e sulla salute dell’attività geomagnetica sugli esseri umani. Le frequenze di picco della SR sono soggette a una moderata variazione giornaliera di circa ± 0,5 Hz. È interessante notare che le prime quattro modalità della SR si trovano all’interno dell’intervallo di frequenza delle prime quattro bande EEG (ovvero Delta 0,5–3,5 Hz, Theta 4–7 Hz, Alpha 8–13 Hz e Beta 14–30 Hz).
Alcuni studi hanno anche scoperto che le onde cerebrali umane e la SR hanno lo stesso intervallo di frequenza. Il corpo umano rileva, assorbe e risponde ai campi elettromagnetici naturali attraverso il processo di adattamento della risonanza di frequenza. Attraverso questo adattamento, i campi elettromagnetici naturali possono influenzare i fenomeni di comunicazione biologica nella comunicazione tra cellule nel corpo umano. Pall (2013) ha anche riferito che l’esposizione ai campi elettromagnetici promuoverebbe l’afflusso di Ca2+ attraverso il canale del Ca2+ voltaggio-dipendente, che può aumentare la concentrazione di Ca2+ nel citosol e quindi causare effetti biologici. Wang (2019) ha anche sottolineato che la stimolazione magnetica a frequenza estremamente bassa può indurre attività a bassa frequenza e portare a effetti di risonanza nel cervello umano.
Il “meccanismo biofisico” alla base degli effetti sulla salute umana potrebbe spiegare gli impatti biologici e sanitari dell’attività geomagnetica. Un numero crescente di psichiatri sta integrando i trattamenti di elettrofisioterapia nella propria pratica clinica perché sono non invasivi, hanno pochi effetti collaterali e possono trattare contemporaneamente ansia, depressione e insonnia. I nostri risultati relativi al miglioramento del SOL suggeriscono che la SR può entrare in risonanza con le onde cerebrali dei partecipanti a 7,83 Hz, rilassando il corpo e facilitando così l’addormentamento e l’aumento della durata totale del sonno. Un’altra ipotesi è che i campi elettromagnetici siano associati ai metaboliti della melatonina umana, il che potrebbe anche spiegare il miglioramento della durata totale del sonno e della qualità del sonno osservati nei partecipanti dopo quattro settimane di trattamento. Tuttavia, questo studio non ha dimostrato un aumento significativo della percentuale di sonno profondo (SWS%). Ciò potrebbe essere correlato alle dimensioni ridotte del campione o all’effetto della PSG sulla prima notte. La durata del trattamento di quattro settimane potrebbe essere troppo breve o potrebbe non avere ancora effetto sulla melatonina. Pertanto, questi risultati e ipotesi richiedono indagini più rigorose e a lungo termine. Una recente revisione sistematica e meta-analisi della CBTi ha mostrato effetti significativi sui sintomi diurni, inclusa la sonnolenza diurna, sebbene l’entità dell’effetto fosse da piccola a moderata. Migliorando i sintomi notturni, la CBTi può avere un effetto indiretto positivo sui sintomi diurni. Analogamente, in questo studio, il gruppo trattato con dispositivo per il sonno SR ha avuto un effetto significativo sul grado di sonnolenza diurna, suggerendo che la SR può migliorare la qualità della vita dei pazienti affetti da insonnia durante il giorno (ad esempio, energia/affaticamento, dolore fisico e salute mentale). Inoltre, Kay ha riferito che la SR ha migliorato la depressione.
Oltre ai potenziali benefici per il sonno dimostrati in questo studio, ulteriori effetti terapeutici dell’addestramento al sonno (SR), come il miglioramento della sonnolenza diurna e della depressione, nonché il ruolo dell’SR in queste condizioni correlate, richiedono ulteriori indagini. Sebbene si sia trattato di uno studio randomizzato in doppio cieco, esistono delle limitazioni. In primo luogo, la dimensione del campione era molto piccola (N = 40), sebbene abbiamo raggiunto la dimensione stimata del campione (N = 38). In secondo luogo, diversi pazienti avevano assunto ipnotici e non erano stati in grado di interromperli, ma hanno mantenuto lo stesso farmaco e dosaggio per tutta la durata dello studio. Potrebbero verificarsi errori di campionamento se si includono solo i partecipanti che non assumevano farmaci. In terzo luogo, l'”effetto prima notte” dovrebbe essere considerato quando si somministra lo studio psicosomatico del sonno (PSG), in quanto potrebbe spiegare il miglioramento osservato. Tuttavia, solo il gruppo che ha utilizzato il dispositivo per il sonno SR ha mostrato un miglioramento significativo nel PSG, e questo risultato supporta l’effetto dell’SR sul sonno. Inoltre, non possiamo verificare realmente la compliance, ma abbiamo chiesto ai nostri partecipanti di accendere il dispositivo ogni notte durante il periodo di studio.
Questo studio dimostra che la Risonanza di Schumann (SR) può ridurre i sintomi dell’insonnia, come confermato da misurazioni sia oggettive che soggettive, sebbene la dimensione del campione sia ridotta. Studi futuri dovrebbero indagare i potenziali effetti psicologici e fisici della Risonanza di Schumann con campioni più ampi e periodi di follow-up più lunghi per valutarne l’efficacia e gli effetti collaterali ed esplorarne i possibili meccanismi.
I dati a supporto dei risultati di questo studio sono disponibili su richiesta motivata del primo autore o dell’autore corrispondente, in attesa dell’approvazione del Comitato Etico dell’Ospedale Chang Gung. Inoltre, i dati anonimizzati dei singoli partecipanti sono disponibili contattando il primo autore o l’autore corrispondente via e-mail. I dati sono disponibili immediatamente dopo la pubblicazione, senza data di scadenza.
Questo studio è stato concepito dal Professor Guilleminault prima della sua scomparsa, avvenuta il 9 luglio 2019. Sebbene non abbia potuto essere l’autore corrispondente di questo studio, desideriamo esprimergli la nostra gratitudine e il nostro apprezzamento. È stato una delle figure più importanti e fondamentali nel campo della medicina del sonno. Senza la sua ispirazione e la sua visione, non saremmo stati in grado di completare questo studio. Questo studio è stato supportato dalle sovvenzioni CMRPG 3J 0131 e 3J 0133 del Chang Gung Memorial Hospital al Dott. Yu-Shu Huang e dalla sovvenzione CMRPG 3L0291 del Chang Gung Memorial Hospital al Dott. Wei-Chih Chin.
Gli autori dichiarano di non avere alcun accordo o collegamento finanziario relativo a questo studio. Questa ricerca non ha ricevuto sovvenzioni specifiche da enti pubblici, commerciali o no-profit. Il brevetto TW M530656 U (dispositivo SR) appartiene al Professor Ling-Sheng Jang. Gli autori dichiarano di non avere altri conflitti di interesse in questo lavoro.
1. Morin CM, Benca R. Insonnia cronica. Lancet. 2012;379:1129–1141. doi:10.1016/S0140-6736(11)60750-2
2. American Academy of Sleep Medicine. Classificazione internazionale dei disturbi del sonno.
Terza edizione. Darien (IL): American Academy of Sleep Medicine; 2014. 3. Bertisch SM, Pollock BD, Mittleman MA et al. Insonnia con durata del sonno oggettivamente breve e rischio di malattie cardiovascolari e mortalità per tutte le cause: studio Sleep-Heart-Health. Sonno. 2018;41:zsy047. doi:10.1093/sleep/zsy047
4. General E, Vogelzangs N, Penninx BW, et al. Insonnia, durata del sonno, sintomi depressivi e comparsa di dolore muscoloscheletrico cronico multi-sito. Sonno. 2017;40:zsw030.
5. Hein M, Lanquart JP, Loas G, et al. Prevalenza e fattori di rischio del diabete di tipo 2 nelle persone con insonnia: uno studio su 1311 persone indirizzate a studi sul sonno. Sleep. 2018;46:37–45. doi:10.1016/j.sleep.2018.02.006
6. Harvey AG. Insonnia: sintomo o diagnosi? Clin Psychol Rev. 2001;21:1037–1059. doi:10.1016/S0272-7358(00)00083-0 1122 Powered by TCPDF (www.tcpdf.org) https://doi.org/10.2147/NSS.S346941 Nature and Science of Sleep 2022:14 Powered by TCPDF (www.tcpdf.org) DovePress Dovepress Huang et al
7. Baglioni C, Battagliese G, Feige B, et al. L’insonnia come predittore di depressione: una meta-analisi di studi epidemiologici longitudinali. J Affect Disord. 2011;135:10–19. doi:10.1016/j.jad.2011.01.011
8. Dolsen MR, Asarnow LD, Harvey AG. L’insonnia come processo transdiagnostico nei disturbi psichiatrici. Curr Psychiatry Rep. 2014;16:471. doi:10.1007/s11920-014-0471-y
9. Sateia MJ, Buysse DJ, Krystal AD et al. Linee guida per la pratica clinica per il trattamento farmacologico dell’insonnia cronica negli adulti: una linea guida per la pratica clinica dell’American Academy of Sleep Medicine. J Clin Sleep Med. 2017;13:307–349. doi:10.5664/jcsm.6470
10. Morin CM, Jarrin DC, Ivers H et al. Incidenza, persistenza e tassi di remissione dell’insonnia in un periodo di 5 anni. JAMA Netw Open. 2020;3:e2018782. doi:10.1001/jamanetworkopen.2020.18782
11. Maust DT, Lin LA, Blow FC. Uso e abuso di benzodiazepine negli adulti negli Stati Uniti. Psychiatr Serv. 2019;70:97–106. doi:10.1176/appi.ps.201800321
12. Agarwal SD, Landon BE. Modelli di prescrizione di benzodiazepine in ambito ambulatoriale negli Stati Uniti. JAMA Netw Open. 2019;2:e187399. doi:10.1001/jamanetworkopen.2018.7399
13. Buscemi N, Vandermeer B, Friesen C, et al. Efficacia e sicurezza dei trattamenti farmacologici per l’insonnia cronica negli adulti: una meta-analisi di RCT. J Gen Intern Med. 2007;22:1335–1350. doi:10.1007/s11606-007-0251-z
14. Glass J, Lanctôt KL, Herrmann N, et al. Sedativi e ipnotici negli anziani con insonnia: meta-analisi dei rischi e dei benefici. BMJ. 2005;331:1169. doi:10.1136/bmj.38623.768588.47
15. Edinger JD, Arnedt JT, Bertisch SM et al. Trattamenti comportamentali e psicologici per l’insonnia cronica negli adulti: linee guida per la pratica clinica dell’American Academy of Sleep Medicine. J Clin Sleep Med. 2021;17:255–262. doi:10.5664/jcsm.8986
16. Ong J, Sholtes D. Un approccio basato sulla consapevolezza per il trattamento dell’insonnia. J Clin Psychol. 2010;66:1175–1184. doi:10.1002/jclp.20736
17. Gong H, Ni CX, Liu YZ et al. Meditazione mindfulness per l’insonnia: una meta-analisi di studi clinici randomizzati. J Psychosom Re. 2016;89:1–6. doi:10.1016/j.jpsychores.2016.07.016
18. Carotenuto M, Gallai B, Parisi L, et al. Terapia di digitopressione per l’insonnia negli adolescenti: uno studio polisonnografico. Neuropsychiatr Dis Treat. 2013;9:157. doi:10.2147/NDT.S41892
19. Yeung WF, Chung KF, Poon MMK et al. Agopressione, riflessologia e agopuntura auricolare per l’insonnia: una revisione sistematica di studi clinici randomizzati. Sleep Med. 2012;13:971–984. doi:10.1016/j.sleep.2012.06.003
20. Sok SR, Erlen JA, Kim KB. Effetti della terapia di agopuntura sull’insonnia. J Adv Nurs. 2003;44:375–384. doi:10.1046/j.0309-2402.2003.02816.x
21. Yin X, Gou M, Xu J, et al. Efficacia e sicurezza del trattamento con agopuntura per l’insonnia primaria: uno studio randomizzato controllato. Sleep Med. 2017;37:193–200. doi:10.1016/j.sleep.2017.02.012
22. Kirsch DL, Nichols F. Elettroterapia: stimolazione cranica per il trattamento di ansia, depressione e insonnia. Psychiatr Clin North Am. 2013;36:169–176. doi:10.1016/j.psc.2013.01.006
23. He Y, Sun N, Wang Z, Zou W. Effetto della stimolazione magnetica transcranica ripetitiva (rTMS) sull’insonnia: un protocollo per una revisione sistematica. BMJ open. 2019;9:e029206. doi:10.1136/bmjopen-2019-029206
24. Belisheva NK, Popov AN, Petukhova NV, et al. Valutazione qualitativa e quantitativa degli effetti delle fluttuazioni del campo magnetico terrestre sul funzionamento del cervello umano. Biofizika. 1995;40:1005–1012.
25. Mulligan BP, Suess-Cloes L, Mach QH et al. Geopsicologia, matrice geofisica e comportamento umano. L’uomo e la geosfera, Nova Science Publishers; 2010: 115–141.
26. Wang CX, Hilburn IA, Wu DA, et al. Trasduzione del campo magnetico terrestre, rilevata dall’attività della banda alfa nel cervello umano. eneuro. 2019;6(2):ENEURO.0483–18.2019. doi:10.1523/ENEURO.0483-18.2019
27. Sentman DD. Risonanze di Schumann. In: Volland H, a cura di. Handbook of Atmospheric Electrodynamics. Boca Raton (FL): CRC Press; 1995:267–298.
28. Cherry N. Risonanze di Schumann, un plausibile meccanismo biofisico per gli effetti del sole sulla salute umana. Natural Hazards. 2002;26:279–331. doi:10.1023/A:1015637127504
29. Persinger MA. Frequenze di risonanza di Schumann nell’attività elettroencefalografica quantitativa: implicazioni per le interazioni Terra-cervello. Int Lett Chem Phys Astron. 2014;11:24–32. doi:10.18052/www.scipress.com/ILCPA.30.24
30. Ghione S, Mezzasalma L, Del Seppia C, et al. Le perturbazioni geomagnetiche di origine solare influiscono sulla pressione arteriosa? J Hum ipertenico. 1998;12:749–754. doi:10.1038/sj.jhh.1000708
31. Burch JB, Reif JS, Yost MG. I disturbi geomagnetici sono associati a una ridotta escrezione notturna di un metabolita della melatonina negli esseri umani. Neurosci Lett. 1999;266:209–212. doi:10.1016/S0304-3940(99)00308-0
32. Rechtschaffen A, Kales A. Un manuale di termini, tecniche e sistemi di punteggio standardizzati per le fasi del sonno umano. Psychiatry Clin Neurosci. 1968;55:305–310.
33. Buysse DJ, Reynolds CF, Monk TH et al. L’indice di qualità del sonno di Pittsburgh: un nuovo strumento per la pratica e la ricerca psichiatrica. Psychiatrieforschung. 1989;28:193–213. doi:10.1016/0165-1781(89)90047-4
34. Tsai PS, Wang SY, Wang MY, et al. Valutazione psicometrica della versione cinese del Pittsburgh Sleep Quality Index (CPSQI) in soggetti con insonnia primaria e soggetti di controllo. Qual Life Res. 2005;14(8):1943–1952.
35. Johns MW. Un nuovo metodo per misurare la sonnolenza diurna: la scala della sonnolenza di Epworth. Sleep. 1991;14:540–545. doi:10.1093/sleep/14.6.540
36. Brazier JE, Harper R, Jones NM, et al. Validazione del questionario sanitario SF-36: una nuova misura di esito per l’assistenza primaria. BMJ. 1992;305:160–164. doi:10.1136/bmj.305.6846.160
37. Koffel EA, Koffel JB, Gehrman PR. Una meta-analisi della terapia cognitivo-comportamentale di gruppo per l’insonnia. Sleep Med Rev. 2015;19:6–16. doi:10.1016/j.smrv.2014.05.001
38. Persinger MA, Psych C. Morte improvvisa inaspettata negli epilettici dopo improvvisi e intensi aumenti dell’attività geomagnetica: prevalenza dell’effetto e possibili meccanismi. Int J Biometeorol. 1995;38:180–187. doi:10.1007/BF01245386
39. Stoupel E, Abramson E, Sulkes J, et al. Associazione tra suicidio e infarto miocardico in relazione al cambiamento delle condizioni ambientali fisiche. Int J Biometeorol. 1995;38:199–203. doi:10.1007/BF01245389
40. Feigin VL, Nikitin YP, Vinogradova TE. Attività solare e geomagnetica: esiste una connessione con l’insorgenza di ictus? Cerebrovasc Dis. 1997;7:345–348. doi:10.1159/000108220
Um Ihnen ein optimales Erlebnis zu bieten, verwenden wir Technologien wie Cookies, um Geräteinformationen zu speichern und/oder darauf zuzugreifen. Wenn Sie diesen Technologien zustimmen, können wir Daten wie das Surfverhalten oder eindeutige IDs auf dieser Website verarbeiten. Wenn Sie Ihre Einwilligung nicht erteilen oder zurückziehen, können bestimmte Merkmale und Funktionen beeinträchtigt werden.